1,物理性质
状态:气体
颜色:无色
气味:刺激性气味
毒性:有毒性
沸点:-10℃
密度:比空气大
溶解性: 易溶于水,在常温、常压下,1体积水大约能溶解40体积的SO2
2,化学性质
(1)SO2与H2O 的反应
实验现象:试管中的水面上升,溶液PH小于7
实验结论:SO2溶于水后形成的溶液显酸性。
反应方程式:

可逆反应:在相同条件下既能向正反应方向进行,又能向逆反应方向进行的反应。
可逆反应特点:正反应和逆反应均不彻底,反应物和生成物共存。
(2)与氢氧化钠溶液反应,
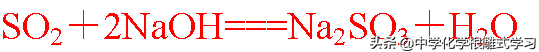
实验室用来吸收二氧化硫,防止污染环境。
(3)与氧化钙反应
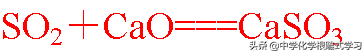
以上三个反应说明二氧化硫具有酸性氧化物的通性: 与水反应生成酸,与碱性氧化物反应生成盐,与碱反应生成盐和水(酸性氧化物的定义)
(4)漂白性:与某些有色物质(如品红)生成不稳定的无色物质,加热或久置可恢复原来的颜色。 利用漂泊性可以检验二氧化硫。
(5)还原性
SO2能使KMnO4溶液,氯水或溴水褪色,可用此法检验SO2。
(6)弱氧化性

所以二氧化硫的化学性质包含四个方面:酸性氧化物的通性,漂泊性,还原性,弱氧化性。